ショウジョウバエによる統合的遺伝学実験 †
作成中
実験のねらいと特徴 †
遺伝の学習で重要な「遺伝子発現」と「遺伝の法則」を、同時に確実に理解させる統合的実験である。 ライフサイクルが比較的短いショウジョウバエを使って、メンデル遺伝の法則を確認する。また、遺伝形質として、アルコール脱水素酵素活性を用いることで、表現型の判定で、酵素活性を測定し、遺伝子型の判定では、DNAをPCR法(用語1)で増殖し、電気泳動により解析する。これらの操作を通して、生化学的手法や分子生物学の手法も体験でき、幅広い生物の分野を統合的に学習することもできる。
実験の流れ †
- 準備
- ショウジョウバエ 雑種第1代(F1)、第2代(F2)の飼育
- 材料、試薬、器具の準備
- 前説明
- メンデル遺伝の法則
- ショウジョウバエの取扱い方
- アルコール脱水素酵素と測定法について
- DNAの抽出法とPCR法について
- 電気泳動の方法ついて
- 実験中
- ショウジョウバエの形態観察
- 酵素活性の測定による表現型の判定
- DNA抽出
- PCR法によるDNA増幅
- 電気泳動による遺伝子型の判定
- 実験後
- レポート作成と提出
- 片付け
はじめに †
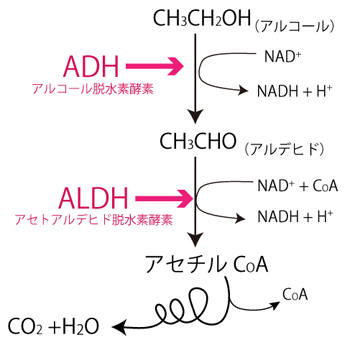
ショウジョウバエは飼育が容易で世代時間が短く、多くの突然変異体が分離されたため、20世紀初頭から遺伝分野の実験動物として重用されてきた。さらに、分子生物学的手法が盛んになった20世紀後半からは、人為的な突然変異系統を生み出す技術や遺伝子組み換え技術を合わせ、「生きた試験管」と呼ばれるほど生物学研究に不可欠な実験動物となった。とりわけ、発生遺伝学の分野では、ショウジョウバエで初めて発見された形態形成遺伝子群が多細胞生物の体作りにおいて共通の働きを持つことが明らかとなり、モデル動物としての地位は揺るぎないものとなっている。代謝系においても、ヒトを含む哺乳類との間にオルソロガス遺伝子(用語2)が多数存在することが知られているので、酵素と遺伝(遺伝子)を考える学生実験において、学生の興味を惹きやすい材料であると言える。 この実験では、ショウジョウバエにもヒトにも存在するアルコール脱水素酵素(ADH)とその遺伝子(Adh)に着目し、遺伝子の配分と酵素活性という形質がリンクしていることを確かめる。ADHはアルコール(主としてエチルアルコール)から水素を奪って補酵素(用語3)であるNAD+を還元し、アルデヒドを生成する酵素である(図1)。生成したアルデヒドはアセトアルデヒド脱水素酵素(ALDH)により酸化されて無害な物質になる。
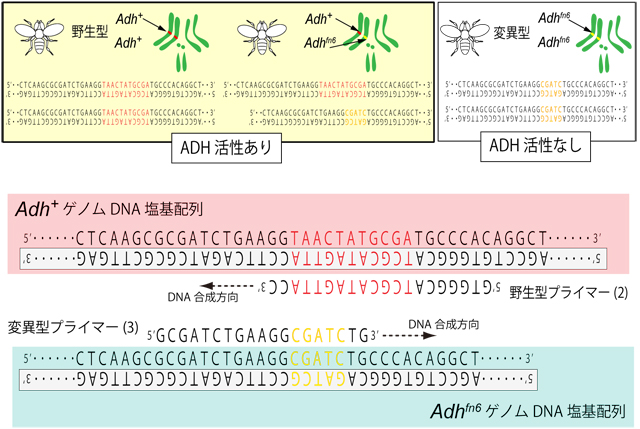
野生のショウジョウバエは、酵母を栄養源としているので、熟した果物、発酵した樹液、酒など、アルコール濃度の高い環境で生活している。そのため、野生型は、ADHおよびALDHの活性が高い。しかし、ADH活性のない突然変異体系統も分離・維持されている。野生型の純系(Adh+/Adh+)と酵素活性のない突然変異系統(Adhfn6/Adhfn6)を交配すると、メンデルの法則に従って、雑種第1代(F1)は、すべてADH活性のある(Adh+/Adhfn6)となり、F1同士を交配した雑種第2代(F2)にはADH活性のあるものとないものが理論的には、3:1の割合で生じる。酵素活性は、ショウジョウバエの体液にアルコール(基質)、NAD+(水素の受け皿となる補酵素)、NBT(Nitro Blue Tetrazolium)(水素を受け取って発色する色素)を添加し、その発色によって判別する。(ADH活性がないとごく薄い黄色のまま、ADH活性があると青色になる。)
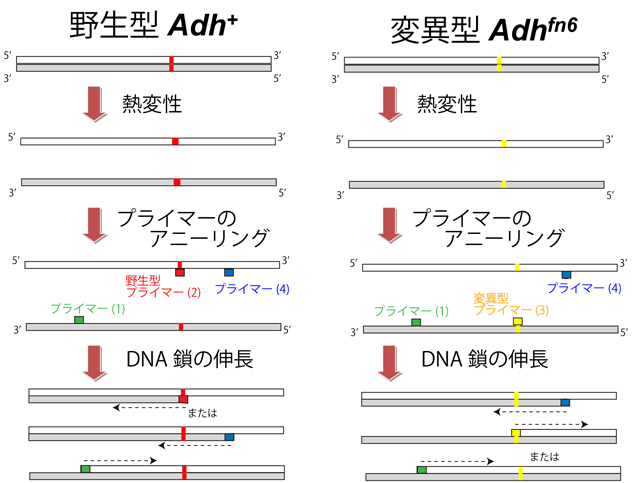
一方、遺伝子型の判定は、ADH活性の有無だけではわからない。なぜなら、Adh+(野生型)が優性のため、ADH活性のあった個体の遺伝子型には、Adh+/Adh+とAdh+/Adhfn6 のふたとおりが存在するからである。DNA塩基配列解析(DNAシークエンス)を行えば、遺伝子型の判別は、可能であるが、コストと時間がかかる。調べたい遺伝子の塩基配列が野生型と変異型の両方で明らかになっていて、次のいずれかの場合は、PCR法によって簡便に判定することが可能である。1)明らかな長さの差がある場合(挿入または欠失)、2)数塩基以上にわたって配列が入れ替わっている場合(置換)、3)点突然変異であっても、その変異制限酵素認識部位が存在する場合。本実験で使用するAdh+とAdhfn6は図2に示すように一部の配列が入れ替わっている2)の形なので、この部分にプライマーを設計することで判別が可能となる。 PCR法はサンプルから抽出したDNA(今回はショウジョウバエゲノム(用語4) DNA)をテンプレート(鋳型)として、DNA複製をマイクロチューブ内で繰り返し行う方法で、DNA合成反応のきっかけとなる短いDNA断片(プライマー(用語5))で挟まれた部分のみが数百万倍に増幅される。今回はAdh+の特徴ある部分にのみ結合する"野生型プライマー(2)"とAdhfn6の特徴ある部分にのみ結合する"変異型プライマー(3)"を使って判別を試みる(図2参照)。反応液内に野生型のゲノムDNAがあった場合、"共通プライマー(1)"と"野生型プライマー(2)"が向かい合うように結合するので、この間の約600塩基対が増幅される。一方、Adhfn6ゲノムDNAが存在した場合 "変異型プライマー(3)"と"共通プライマー(4)"が向かい合うように結合するので、この間の約300塩基対が増幅をされる(図3参照)。この結果、遺伝子型がAdh+/Adh+の場合は600塩基対のみの増幅が起こり、Adh+/Adhfn6の場合は600塩基対と300塩基対の両方が増幅されることになる。今回の実験では、酵素活性を測った個体そのものからDNAを取るわけではないので300塩基対のみの増幅が起こるAdhfn6/Adhfn6を合わせて、Adh+/Adh+: Adh+/Adhfn6 : Adhfn6/Adhfn6 = 1 : 2 : 1となることが期待される。
目的と課題 †
- (目的1)酵素活性の有無を測定し、交配で得た雑種第1および第2代の表現型を調べる。
- 課題1:ショウジョウバエの雄雌の違いを観察し、スケッチや言葉で表現する。
- 課題2:アルコール脱水素酵素の活性を測定し、結果を表1,2にまとめる。
- (目的2)PCR法で増幅した1個体のDNAを電気泳動することで、交配で得た雑種第1および第2代の遺伝子型を調べる。コントロールとして、親世代の遺伝子型も調べる。
- 課題3:1個体からDNAを抽出し、PCRにかける。
- 課題4:増幅したDNAサンプルを電気泳動にかけ、バンドから遺伝子型の判定をして、表3にまとめる。
ショウジョウバエの形態の観察 †
材料 †
- ショウジョウバエ(Drosophila melanogaster):飼育法や準備の詳細な手順は『材料の準備』参照
試薬 †
- ジエチルエーテル
器具 †
- ルーペまたは実体顕微鏡
- 麻酔瓶(ジエチルエーテル入り)
- 白色タイル:観察・作業台
- 竹ひご または平筆:ハエを扱うのに用いる
- マウスパッド:ハエを瓶の底に集めるときに用いる。
手順 †
- 麻酔瓶にジエチルエーテルを2〜3滴スポイトで垂らす(注1)。
- ハエの入ったバイアルをマウスパッドの上などで、軽く叩いて、バイアルの底にハエを落とす(図4左)。
- ハエが落ちたことを確認後、バイアルの蓋をあけ、麻酔瓶の口にバイアルにかぶせる(図4中央)。
- 瓶の口がずれないように合わせた状態で、バイアルが上になるように返し、軽く叩いてハエを麻酔瓶に入れる(図4右)。
- そのまま数十秒置き、ハエが動かなくなっているのを確認後(注2)、タイルの上に取り出し、竹ひごや筆を使って観察する(注3)。
- 雄雌の違いを見つけ、スケッチまたは言葉で表現する。
ポイントやトラブルシューティング †
- 注1:ジエチルエーテルは人にも麻酔作用があるので、換気を十分に行った部屋で作業し、むやみに臭いをかがない。
- 注2:この操作で、通常2〜3分は麻酔にかかり動かない。麻酔のかけすぎると、死んでしまうので、交配実験に使うハエでは、特にかけ過ぎに注意する。翅が背中側に反りかえった場合はかけ過ぎである。
- 注3:ピンセットは力が入りすぎてしまい、ハエを傷つけてしまうので、筆や竹ひごでやさしく扱う。
アルコール脱水素酵素活性測定による表現型の判定 †
材料 †
- ショウジョウバエ(Drosophila melanogaster)野生型(Oregon–R)と アルコール脱水素酵素変異体(Adhfn6)の雑種第1代(F1)および雑種第2代(F2):飼育法や準備の詳細な手順は『材料の準備』参照
試薬 †
詳細や調整については、『試薬の調整法』参照
- ジエチルエーテル
- アルコール脱水素酵素活性測定のための発色用混合液
器具 †
- ハエ麻酔用具
麻酔瓶(ジエチルエーテル入り)
白色タイル:作業台
竹ひご:ハエを扱うのに用いる
マウスパッド:ハエを瓶の底に集めるときに用いる - 爪楊枝(5本/人):ハエを潰すのに用いる。
- マルチウェルストリップ(1枚/2人):酵素活性を判定する容器として用いるのでエッペンチューブなどでも良い。
- 30℃インキュベーター
- マイクロピペッターP200
手順 †
- 麻酔したハエを空のマルチウェルストリップの1穴に1匹入れ、爪楊枝でよく潰す(図5左)(注4)。
- 雑種第1代および雑種第2代の表現型を調べる場合は、どの穴に何代目のハエのサンプルが入っているか記録する。コントロールとして野生型とアルコール脱水素酵素変異型も1匹ずつ準備する(注5)。
- 潰したハエの入っているすべての穴に発色用混合液(アルコール脱水素酵素の基質・発色剤・緩衝液を含む)を100µlずつ加える。30℃のインキュベーターで、約60分間反応させる(注6)。
- インキュベーターに入れたマルチウェルストリップを取り出し、発色から、アルコール脱水素酵素活性の有無を表1と2にまとめる注7(図5右)。
活性 1班 2班 3班 4班 5班 6班 7班 合計 有り なし 活性 1班 2班 3班 4班 5班 6班 7班 合計 有り なし
ポイントやトラブルシューティング †
- 注4:爪楊枝は、必ず1匹ごとに取り換えて、サンプルが混ざらないように注意する。
- 注5:マルチウェルストリップの数によるが、一人あたり4から5匹程度の酵素活性を調べるようにする。第1代はコントロール同様で多数調べる必要はない。
- 注6:発色の待ち時間60分の間にDNA抽出を行うとよい。
- 注7:発色の状態は写真等で記録しておくと分かりやすい。
PCR法による遺伝子型の判定 †
材料 †
- ショウジョウバエ(Drosophila melanogaster)野生型(Oregon–R)と アルコール脱水素酵素変異体(Adhfn6)の雑種第1代(F1)および雑種第2代(F2):飼育法や準備の詳細な手順は『材料の準備』参照
試薬 †
詳細や調整については、『試薬の調整法』参照
- キレックス溶液
- 中和液
- PCR反応液
- 1%アガロースゲル:電気泳動ゲル
- TAEバッファー:電気泳動時に泳動槽を満たす溶液
- ローディングバッファー
- サイズマーカー
- エチジウムブロマイド溶液
器具 †
- ハエ麻酔用具
麻酔瓶(ジエチルエーテル入り)
白色タイル:作業台
竹ひご:ハエを扱うのに用いる
マウスパッド:ハエを瓶の底に集めるときに用いる - エッペンチューブ(2本/人)
- 爪楊枝(5本/人)
- マイクロピペッターP1000、P200、P20
- フローティングフォーム
- 沸騰槽
- 冷却槽(氷入りバケツ)
- 高速遠心分離機
- サーマルサイクラー
- 電気泳動装置(観察・撮影装置)
手順 †
- DNAの抽出
- 1.5ml エッペンチューブにハエを1個体入れて、できるだけ粉々に、爪楊枝で押し潰す(注8)(図6左)。
- キレックス溶液の入った試験管のふたをしっかり閉め、よく撹拌してからふたを開け、P1000のマイクロピペッターで、キレックス溶液を250µl吸い取って、ハエの入っている1.5ml エッペンチューブに入れる。
- エッペンチューブは、しっかり蓋をして、フローティングフォームにはめ込んで、10分間煮沸する(図6右)。
- 煮沸後、チューブを取り出して氷上で3分程度保冷する。
- P1000のマイクロピペッターを使って、中和液350µlをiv)のエッペンチューブに加え、ふたをしてよく混ぜる。
- 高速遠心分離機にチューブをセットし、12000rpmで5分間遠心する。
- 遠心が終わったら、沈殿を崩さないよう静かにチューブを取り出して氷上に立てる。
- 上清には、ハエのゲノムDNAが含まれている(DNA抽出液)ので、これを鋳型としてPCR反応を行う。
- PCRによるDNA増殖
- 電気泳動
- 電気泳動槽に1%アガロースゲルとTAEバッファーを入れ準備する。
- サーマルサイクラーにかけたエッペンチューブに、P20のマイクロピペッターで、ローディングバッファー5µlを加え、ピペッティングして、溶液をよく混ぜる。
- 電気泳動槽のアガロースゲル左端のウェル(窪み)に、サイズマーカーを3µl入れる(図8左)。サイズマーカーは、ゲル1枚につき1箇所でよい。
- ウェルにii)で用意したサンプル溶液10µlを静かに入れ(注11)、ウェルの番号とサンプル内容を記録する(注12)。
- ふたをして、100Vで20〜30分 電気泳動する(注13)。
- 通電を止めて泳動を終了する。
- ゲルを壊さないよう、枠ごと泳動槽から取り出し、ゲルのみを染色用の容器に押し出す。エチジウムブロマイド溶液(注14)を加えて30分染色する。
- ゲルを取り出して、観察装置において紫外線除去フィルターごしに、ゲルを観察し、写真を撮影する(注15)。(図8右)。 写真から、ハエの遺伝子型の判定を行い、結果を表3にまとめ、第2代の遺伝子型の分離比を求める。 遺伝子型が野生型ホモ(Adh+/Adh+)であれば、600bpのDNA断片のみが、変異型ホモ (Adhfn6/Adhfn6)であれば、300bpのDNA断片のみが観察され、ヘテロ(Adh+/Adhfn6)であれば、600bpと300bpの両方の断片が観察される。
表3 ショウジョウバエ雑種第2代の遺伝子型
遺伝子型 1班 2班 3班 4班 5班 6班 7班 合計 Adh+/Adh+ Adh+/Adhfn6 Adhfn6/Adhfn6
ポイントやトラブルシューティング †
- 注8:エッペンチューブには、何代目のサンプルか、わかるように印をつけておく。
- 注9:DNA抽出液は、沈殿を吸い込まないように、液面付近からP20マイクロピペッターで吸い取る。
- 注10:PCR反応には数時間を要するので、反応の終わったチューブは電気泳動実験まで凍結保存する。
- 注11:ウェルに、流し込むくらいのつもりでゆっくりと注入する。(チップの先でゲルを突き破らないように、また、勢いよく入れて、他のウェルに入いらないように注意する。マイクロピペッターの使い方をよく読む。
- 注12:ウェルにサンプルを入れたら、通電終了まで泳動槽を移動したり、衝撃を与えたりしない。
- 注13:ローディングバッファーの青色素が陽極に向かって流れていくのを目視により確認し、流しすぎに注意する。
- 注14:エチジウムブロマイド溶液は、DNAと結合し、突然変異を誘発する変異原物質(発がん物質)であるので、取扱には十分注意し、素手で扱わないように注意する。
- 注15:紫外線ランプを直視しないようにする。
実験を成功させるための留意点 †
実験前
- 実験のスケジュールに合わせて、処女雌を確保し、雑種第1代、第2代を用意する。
- 電気泳動槽は、実験のスケジュールによっては、あらかじめ教員が用意しておく。
実験中
- マイクロピペッター、サーマルサイクラー、電気泳動装置の使い方を細かく指導する。
実験後
- エチジウムブロマイド溶液の廃液は十分に注意して回収する。その他の試薬の廃棄についても所属機関の規定に従うこと。
本実験の発展 †
- 『唾線染色体の観察』や『集団遺伝実験』とも組み合わせ、さらに生物学の統合的な実験とすることができる。
資料 †
材料の準備 †
- ショウジョウバエ(Drosophila melanogaster)の野生型(Oregon–R)とADH変異系統(Adhfn6)
入手先:京都工芸繊維大学 ショウジョウバエ遺伝資源センター(http://www.dgrc.kit.ac.jp/)#105669 Oregon-R-C
#106615 Adh[fn6] cn[1]; ry[506]
- 飼育法:川崎陽久ら(2007)に詳細に記載、下記URL参照
http://koara.lib.keio.ac.jp/xoonips/modules/xoonips/listitem.php?index_id=9223
- 下記の手順によって雑種第1代(F1)および雑種第2代(F2)を用意する。
- 羽化後8時間以内のハエに麻酔をかけ、雄雌を分ける。
- 野生型♀とアルコール脱水素酵素変異体♂(または、野生型♂とアルコール脱水素酵素変異体♀)をそれぞれ数匹ずつ、新しい培地の入ったバイアルに入れて交配させる。
- 1週間25℃で飼育すると、産卵が行われ、幼虫が現れるので、成虫をバイアルから取り出す。続く1週間で羽化してくる成虫が雑種第1代となる。
- 雑種第1代の♂と♀を数匹ずつを新しい培地の入ったバイアルに入れて、1週間25℃で飼育し、成虫を取り除く。 続く1週間で羽化してくる成虫が雑種第2代となる。
試薬の調整法 †
- アルコール脱水素酵素活性測定のための発色用混合液
アルコール脱水素酵素活性測定のための発色用混合液 約50ml 0.2M リン酸バッファー pH7.4 9ml NBT 5mg/ml 9ml NAD 50mg/ml 1.8ml 2-ブタノール 1.8ml PMS 2mg/ml 0.9ml 蒸留水 27ml - キレックス溶液 (10% Chelex®-100、50mM Tris-HCl (pH 11))
キレックス溶液 250ml 1M Tris (pH 7.5) 12.5ml 蒸留水 約180ml Chelex®-100 (10%) 25g NaOH pH11になるように滴下 蒸留水で250mlにメスアップ - 中和液(167mM Tris-HCl pH 7.5 )
中和液 250ml 1M Tris (pH 7.5) 41.75ml 蒸留水で250mlにメスアップ - PCR反応液 (1反応分の組成)
PCR反応液 45µl PCR Master Mix(2x) Promega社 #M7502 25µl 100 pmol/µl Primer L1F (TTCCTCTTGGAAAATCACCTG 21 mer) 0.1µl 100 pmol/µl Primer L1R (GTGGGCATCGCATAGTTACC 20 mer) 0.1µl 100 pmol/µl Primer MutF (GCGATCTGAAGGCGATCTG 19 mer) 0.05µl 100 pmol/µl Primer MutR (CCGTTGATCAGGACATCGAC 20mer) 0.05µl DDW(滅菌蒸留水) 19.7µl - ローディングバッファー (0.25% xylene cyanol FF, 1mM EDTA, 30% Glycerol)
ローディングバッファー 50ml 1% xylene cyanol FF 12.5ml 500mM EDTA 0.1ml Glycerol 15ml 蒸留水で50mlにメスアップ - エチジウムブロマイド溶液:10 mg/ml のストックソリューションを作り、使用時にTAEバッファー100 mlあたり 1 µl 添加する。発がん性を持っているので、取り扱い時には手袋を着用のこと。学生には触れさせずに、教員が取り扱うのが望ましい。
エチジウムブロマイド溶液:10 mg/ml 約100ml ethidium bromide (EtBr) 1g 蒸留水 100ml - TAEバッファー: 電気泳動時に泳動槽を満たす溶液
50倍濃度(50 x TAE: 2M Tris, 2M 酢酸, 0.05M EDTA)を作成し、使用時に希釈する。
50×TAEバッファー 250ml Tris 60.5g 氷酢酸 14.3ml 500mM EDTA 25ml 蒸留水で250mlにメスアップ 500mM EDTA 250ml ethylene-diamine-tetra-acetic acid ・2Na ・2H2O 46.5g NaOH (粒状) 約5g 5N NaOH pHを8になるように滴下 蒸留水で250mlにメスアップ - サイズマーカー: invitogen 100bp DNA ラダー
参考文献 †
- 川崎陽久ら(2007) 学生実験用教材としてのショウジョウバエの取扱い, 慶應義塾大学日吉紀要・自然科学編 42:1-15
- 小野裕剛ら(2008) リベラルアーツとしての統合的遺伝学・分子生物学教育, 慶應義塾大学日吉紀要・自然科学編 43:1-12
- Brogna S, Ashburner M (1997) The Adh-related gene of Drosophila melanogaster is expressed as a functional dicistronic messenger RNA: Multigenic transcription in higher organisms. EMBO J 16(8): 2023-2031
用語解説 †
- PCR法
- PCR(Polymerase Chain Reaction、ポリメラーゼ連鎖反応)とは、「熱変性」、「アニーリング」、「伸長」と呼ばれる3つの過程を繰り返すことにより、ごく微量のDNAを鋳型として必要な部分を選択的に増幅できる技術である。2本鎖DNA断片は、95℃程度に加熱されると1本鎖に分離する(熱変性)。熱変性したDNA断片は50〜68℃程度に冷却されると再び相補的な2本鎖を形成しようとする(アニーリング)。この時、人工合成した10〜30塩基のごく短いDNA断片(プライマーと呼ばれる)を大量に加えていると、プライマーが優先的に相補的な配列に結合する。次に72℃に温度を上げると、耐熱性DNAポリメラーゼが働き、プライマーを起点にdNTPsを材料としてDNAの合成が始まる。この段階が「伸長」である。dNTPsとは、A(アデニン)、T(チミン)、C(シトシン)、G(グアニン)を含むデオキシヌクレオチド三リン酸が、繋がらずバラバラになった状態のものを指す。2本鎖に伸長したDNAを再び熱変性させると、前回までに合成されたDNAが新たな鋳型となり、上記の温度調節を繰り返すことで、DNAのコピーを倍々に増やすことができる。増幅効率が100パーセントだと仮定すると、30サイクルで2の30乗、すなわち10億倍以上に増幅される計算になる。プライマーの配列を変えることでDNAの任意の領域のみ増幅できるため、この技術は生命科学研究を飛躍的に進歩させた。
- オルソロガス遺伝子
- 「相同な遺伝子」を示す用語の一つ。異なる生物種の遺伝子で、共通祖先の同一遺伝子に由来し、機能も近いものを「オルソロガス遺伝子」という。重複によって、一つの生物ゲノム内に相同な遺伝子が複数存在する場合は「パラロガス遺伝子」という。
- 補酵素
- 酵素が働く際に、基質や生成物と一時的に結合して化学反応を助ける低分子化合物である。酵素反応によって消費されない点では酵素と同じである。タンパク質でできた酵素本体(アポ酵素)とは固く結ばれていないので、分離することができるが、分離してしまうとどちらも活性を失う。再度混合すると活性を取り戻す
- ゲノム(ゲノムDNA)
- 一つの生物種を特徴付ける遺伝子のセットをゲノムと呼び、核に含まれる染色体DNAとミトコンドリアDNA(植物の場合は葉緑体DNA)を合わせた遺伝情報のセットである。ゲノムDNAの中には遺伝子でない部分(繰り返し配列やウイルスの残骸、進化の過程で使われなくなった遺伝子の残骸など)が大量に含まれている。このため、遺伝子研究においては有効な情報のみを含むmRNAを逆転写したcDNA(相補的DNA)を用いたり、部分的にクローニング(単離)したDNAを用いることも多い。そのため、核から抽出したそのまま(無選別)のDNAを用いるときに「ゲノムDNA」と呼んで区別することもある。
- プライマー
- DNAを合成する酵素「DNAポリメラーゼ」は、相補的なDNA塩基配列情報をもとに、既存配列の3’側にデオキシリボヌクレオチドを結合させていく酵素であるが、きっかけとなる既存配列がないと合成ができない。一方、RNA合成には既存配列が必要ではないので、生体内ではプライマーゼ(酵素)がRNAでできたプライマー(種火)を作り、その後ろにつなげる形でDNAを合成している。試験管内で行うPCR法においては、この性質を利用し、合成したいDNA部分の両端に相当する短い人工合成DNAをプライマーとして添加することで、DNAの特定領域からのDNA合成のみを引き起こすことができる。
印刷用PDFマニュアル †
添付ファイル: