ヒドラの摂餌行動とその認識
摂食時のヒドラ触手運動を観察する。
実験のねらいと特徴
ヒドラの体のつくりと摂餌行動の観察を通して、ヒドラの『餌の認識メカニズム』を考察する。
実験の流れ
- 準備
- 材料、試薬、器具の準備
- シャーレに2~5匹のヒドラを分配
- 前説明
- ヒドラについて
- ヒドラの摂食行動について
- スケッチの意義と描き方について
- 実体顕微鏡の使い方について
- 実験中
- ヒドラのスケッチ
- 摂餌行動を観察
- 実験後
- レポートの作成と提出
- ヒドラの回収・片付け
はじめに
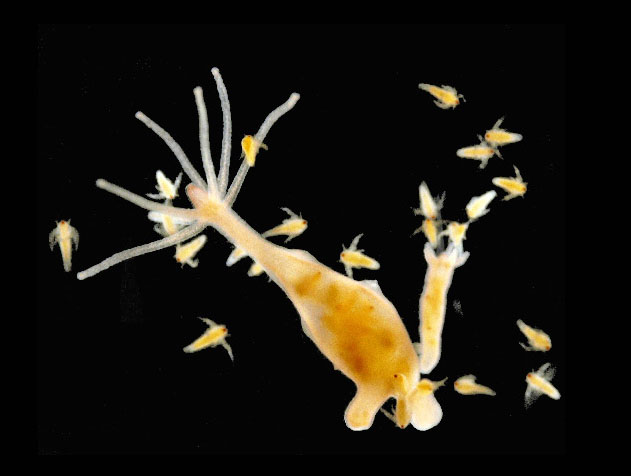
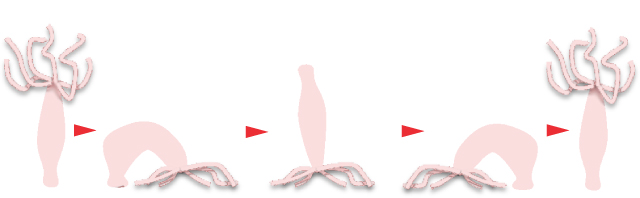
ヒドラは、飼育の容易さ、その構造や行動の面白さから、生物学実験に広く使われている。クラゲ、サンゴやイソギンチャクと共に刺胞動物と呼ばれるグループに属するヒドラは、1 cm前後の淡褐色の動物で池や沼の石や水草に付着して生活する。しかし、固着生活だけにとどまらず、「とんぼがえり」などの方法で移動することもできる(図1)。ヒドラという名前は、ギリシャ神話に登場する9個の頭を持つ蛇に由来している(図2)。
図1.ヒドラのとんぼがえり (移動法の一種)
図2.ギリシャ神話のヒドラ(切手より)
左上:イタリア、右上:ギリシャ、右下:モナコ
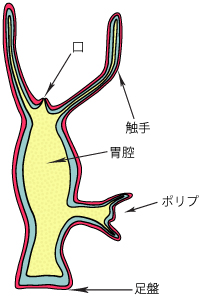
ヒドラの体は、内胚葉と外胚葉の上皮シートが互いに裏領域で接着し合った単純な筒状構造を持つ(図3)。筒の一端は開いた状態になっており、餌を食べる際に口の機能を果たす。両上皮シートは口の周囲から突出して6本前後の触手を形成し、ヒドラの形態を特徴付けている。また、体幹部には、出芽で生じたポリプが見られることもある。ヒドラは卵と精子の受精による有性生殖以外に、出芽ポリプからクローン個体をつくる無性生殖も行うことができる。
図3.ヒドラの構造
内胚葉細胞をブルーで、外胚葉細胞をピンクで示す。
ヒドラは肉食であり、独立した個体として生活するために、活発に摂餌する。ヒドラの摂餌行動は以下のように進行する。餌が触手に接触すると、刺胞細胞から鋭い繊維状の刺胞が発射され、餌の動きを止める。(海水浴でクラゲに刺されて痛みを感じるのは、クラゲの刺胞に刺されたためである)。次に、触手を縮めながら内側へ巻き込むようにして、餌を口に運び、胃腔へ嚥下し、消化する。消化物は、内胚葉細胞の一種である消化細胞に吸収され、栄養となる。一方、非消化物は再び口から排泄される。
目的と課題
- (目的1)ヒドラの構造と動きを観察する。
-
- 課題1: 一個体のヒドラをスケッチする。
- (目的2)摂餌行動における餌認識メカニズムを考察する。
-
- 課題2: 4種類の実験を通して摂餌行動を観察する。
実験結果を表1の様にまとめる。体のどの部分で餌を認識しているか、餌の何を認識しているかについて留意する。
- 課題2: 4種類の実験を通して摂餌行動を観察する。
| 表1.各実験処理に対するヒドラの行動 |
| 実験処理 | ||||
| ヒドラ飼育水 i) |
生きている アルテミア ii) |
アルコール処理 アルテミア iii) |
グルタチオン 溶液 iv) |
|
ヒドラの行動 |
||||
| i)~iv)は、実験手順2での番号を示す。 |
実験
材料
- チクビヒドラ(Hydra magnipapillata)またはエヒドラ(Pelmatohydra robusta)(4-5匹/シャーレ)(4シャーレ/1人)
『ヒドラの飼育法』参照 - アルテミア(Artemia salina)(1.5 mlチューブ1本/2人)
『ヒドラの飼育法』参照 なお、手回し遠心機で集めたアルテミア1mlは、75 mlのヒドラ飼育水で希釈して用いる。 - アルコール処理アルテミア(1.5 mlチューブ1本/2人)
手回し遠心機で集めたアルテミアに同量の100%エタノールを加え、インバートする。この操作をアルテミアの色が白くなるまで、数回繰り返し、エタノールをヒドラ飼育水に置き換えて用いる。このアルコール処理により細胞内可溶成分が除かれる。
試薬
- 100 µMグルタチオン溶液(グルタチオン3mg/ヒドラ飼育水10 ml)
>グルタチオンを100 µMになるようにヒドラ飼育水に溶かす。グルタチオンは酸化型になると効果がなくなるので、実験前に調整する。 2~3日なら冷蔵庫で保蔵可。 - ヒドラ飼育水
『ヒドラの飼育法』参照
器具
- ニップル付きパスツールピペット:4本/1人
- 直径6cmのプラスチックシャーレ:4枚/1人
- スケッチ用紙:1枚/1人
- H以上の硬質鉛筆:1本/1人
- 実体顕微鏡:1台/1人
手順
- 各自ヒドラの入ったシャーレを取り、実体顕微鏡でヒドラをよく観察しスケッチする。
- ヒドラにおける餌認識メカニズムの解析 (結果は表1にまとめる)。
-
- 1枚目のシャーレ中のヒドラに、ヒドラ飼育水をパスツールピペットで与え(注1)、その後の行動を観察する(図4)。
- 2枚目のシャーレ中のヒドラに生きているアルテミア幼生をパスツールピペットで与え(注2)、その後の行動を観察する。
- 3枚目のシャーレ中のヒドラにアルコール処理したアルテミア幼生を同様に与え、その後の行動を観察する。なお、アルコール処理によってアルテミア幼生の細胞内部のほとんどの可溶成分は、取り除かれている。
- 4枚目のシャーレ中のヒドラにグルタチオン溶液(注3)を同様に与え、その後の行動を観察する。
- (lightboxで画像ウインドウが開きます)

図4.観察シャーレ
- (lightboxで画像ウインドウが開きます)

図4.材料
ポイントやトラブルシューティング
- 注1:各実験でのパスツールピペットの操作法は、ピペットの先端をヒドラの口に近づけ、できるだけ穏やかな排出を心がける。強い水流はヒドラの摂餌行動の解析に適さない。
- 注2:パスツールピペットを他の処理に使い回さない(グルタチオン溶液を吸ったパスツールピペットを使って、アルコール処理アルテミアをヒドラに与える、と、ヒドラはパスツールピペットに残っていたグルタチオン溶液に反応してしまう可能性がある)。
- 注3:分量の目安はピペットの先1 cmくらい。
実験を成功させるための留意点
実験前
- ヒドラの準備には少なくとも2週間の余裕をもつ。
- 餌であるアルテミアも4日ほど余裕をもって準備すること。室温条件などにより上手く孵化せず、アルテミアが不足する場合がある。
- パスツールピペットは、処理ごとに分けて使う必要があるので、色違いのテープなどを貼り区別する。
実験中
- 摂餌実験は、それぞれの処理ごとに約5分間の連続観察が望ましい。
- パスツールピペットを使いまわさないように注意させる。
実験後
- アルコール処理したアルテミアは、死んだ餌というよりも、細胞内部の可溶成分が除去された状態であることを、前説明時に強調しておく。
- グルタチオン溶液を添加したプラスチックシャーレを使い回す場合、良く洗うこと。シャーレに付着しているグルタチオンにヒドラが反応してしまい、実験結果が上手く出ない場合がある。
本実験の発展
『ヒドラの解離と構成細胞の観察・同定』と組み合わすことが可能。
資料
参考映像
ヒドラの採餌行動
参考文献
- 小泉修(1993) ミクロスコピア10:172-176
- 小泉修(1993) ミクロスコピア10:238-243
用語解説
- 刺胞動物
- ヒドラのほかにイソギンチャクやクラゲも刺胞動物である。これらの動物は、刺激を受けると刺胞(毒針)を放出する。
- 内胚葉
- 発生の初期過程において、原腸陥入後、内側に陥入した胚体領域を内胚葉と呼ぶ。将来、消化管などを形成する。
- 外胚葉
- 発生の初期過程において、原腸陥入後、陥入せず外側に残った胚体領域を外胚葉と呼ぶ。将来、表皮や神経を形成する細胞集団。
- 有性生殖
- 精子と卵などの生殖細胞により、新たな個体を作り出す方法。
- クローン
- 均一な遺伝情報をもった細胞や個体。
- 無性生殖
- 一つの個体が単独で新たな個体を作り出す方法。
- 刺胞細胞
- 袋状の形態を持ち、刺激を受けると袋を反転させながら、内部の刺糸を放出する細胞。
- グルタチオン
- グルタミン酸、システイン、グリシンが結合したトリペプチド。細菌からヒトにいたるまで多くの生物の細胞に可溶性物質として存在する。
印刷用PDFマニュアル
- ヒドラの摂餌行動とその認識
 (504KB)
(504KB)