DNAの抽出と同定
魚類精巣からDNA を分離抽出する。
実験のねらいと特徴
DNAの化学的性質を利用してDNAの抽出(粗精製)を行う。材料には、DNAの含有量が高く、入手しやすい魚類の精巣(ここでは、サケを例に説明)を用いる。有毒なフェノールを使用する抽出方法が一般的であるが、ここでは、濃度の異なる食塩水に対する溶解度の違いを利用し、DNAと核タンパク質によって形成された複合体を安全かつ簡便な手法で抽出する。得られた物質にDNAが含まれることを確認し、遺伝子の実体であるDNAを実感する。
実験の流れ
- 準備
- 材料、試薬、器具の準備
- 精巣の切り分け
- 前説明
- DNAについて
- 抽出の手順
- 遠心機の使い方
- 試薬の注意
- 実験中
- DNAの抽出
- 抽出物の定性と観察
- 実験後
- レポートの作成・提出
- 片付け
はじめに
遺伝情報物質であるDNA(デオキシリボ核酸:Deoxyribonucleic acid)は、糖(デオキシリボース)、リン酸、塩基からなるヌクレオチドという単位分子が長く連なった糸状の生体高分子ある。塩基の種類としてアデニン(A)、チミン(T)、グアニン(G)、シトシン(C)の4種類があり、その並び順が遺伝情報となっている(図1)。ヒトの体細胞1個には、約60億の塩基対が存在する。そのDNAとしての長さは、幅2 nmで1.8 mにもなると換算できる。DNAはこのように非常に長い分子であるが、細胞内ではヒストン(精子の場合はプロタミン)と呼ばれる核タンパク質の芯に巻きつき、さらに幾重にも、らせん状に折り畳まれ、非常に圧縮された形で存在する(図1)。今回用いる手法では、DNAはこのような核タンパク質との複合体として抽出される(文献1)。材料とする魚類を含む真核生物の分裂休止期の細胞では、DNAは細胞のなかでも、さらに2重膜でおおわれた核の中に存在しているので、DNAを取り出すには、DNAを取り巻く周辺構造を壊し、細胞内の(非核)タンパク質等を除去しなければならない。ホモジェナイズ、遠心分離などの物理的手法と濃度の異なる塩溶液に対する溶解性の違いという化学的手法を組み合わせて、DNAを集める。
- (lightboxで画像ウインドウが開きます)
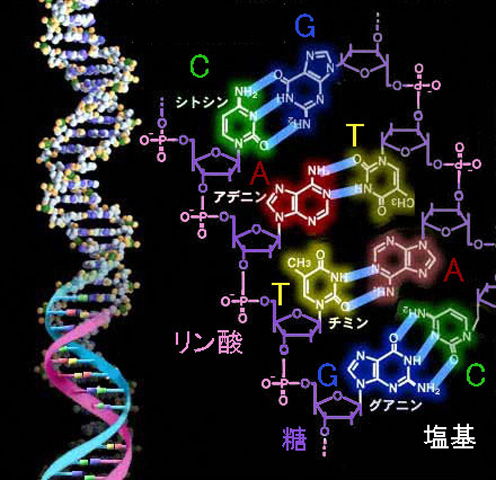
図1.DNA 二重らせん構造と塩基
- (lightboxで画像ウインドウが開きます)
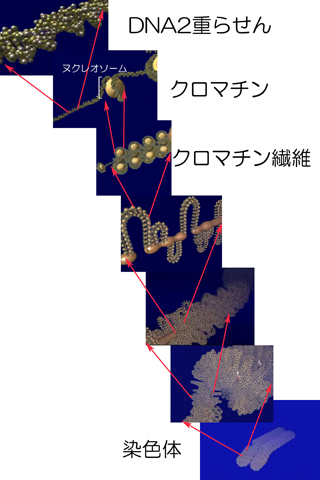
図1.DNA DNAの染色体への折れ畳み方
目的と課題
- (目的1)精巣からDNAを抽出する。
-
- 課題1:実験手順のフローチャートを作成し、各ステップの意味を簡潔に記述する。
- 課題2:手順に従い、作業をおこない、各ステップで生じた様子を記述する。
- (目的2)抽出した物質にDNAが含まれることを確認(定性分析)し、実験の考察をおこなう。
-
- 課題3:定性分析の結果を記述する。
- 課題4:DNAを抽出する材料として、卵巣ではなく、精巣を用いる理由は何故か?細胞あたりのDNA含量、細胞の大きさから、精巣を用いる利点を卵巣と比較して記述する(図2, 図3, 図4参照)。
- (lightboxで画像ウインドウが開きます)

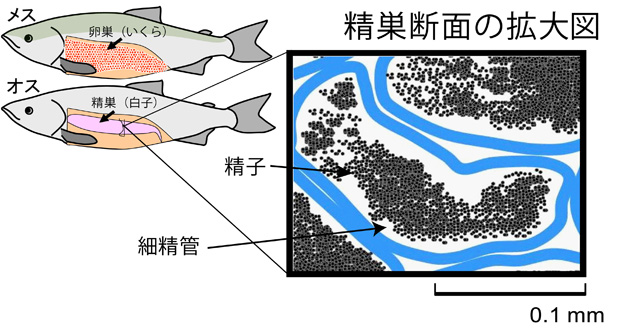
図2.サケ生殖巣 卵巣
- (lightboxで画像ウインドウが開きます)
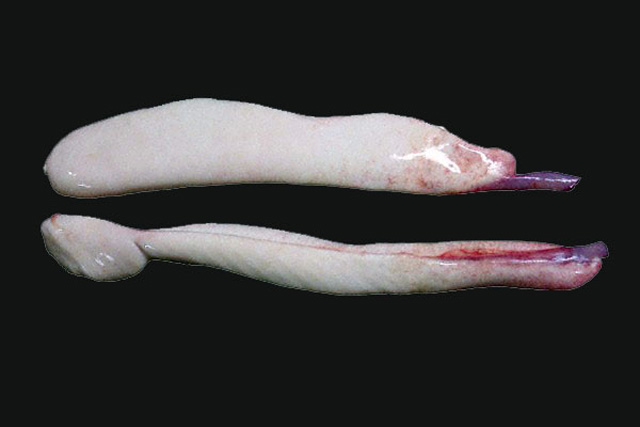
図2.サケ生殖巣 精巣
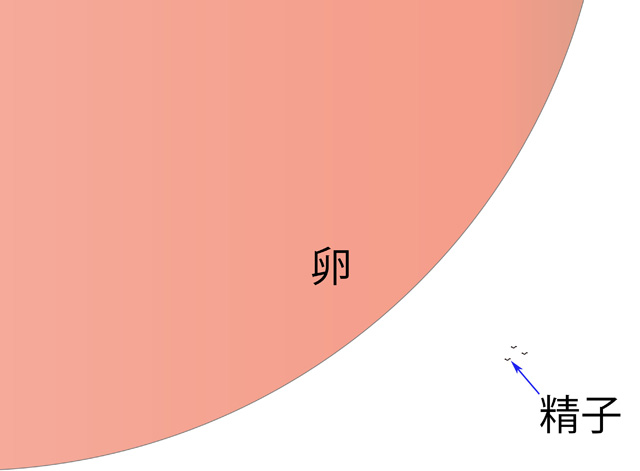
図3.サケの卵と精子 相対的サイズ
サケの卵は、魚類のなかでも極めて大きく、その卵径は、6.2~8.8mmと報告されている(文献2)。一方、精子の頭部は、10μmにも満たない。
実験
材料
- 精巣片:5 mm角/2人(班)
- 1~2mm程度の厚さにスライスして、冷凍庫で保存し、実験当日、5mm角くらい(湿重量15mgくらい)に切り分ける。サケの他、ブリ、ニシン、サバ、タラなどの手に入りやすい魚類の精巣も同様に使うことができる。
試薬
- 1M食塩水:5.8% (w/v)
-
1M食塩水 100 ml NaCl 5.8 g H2Oで100 ml にメスアップ
- 0.12M食塩水:0.7% (w/v)
-
0.12M食塩水 100 ml NaCl 0.7 g H2Oで100 ml にメスアップ
- ジフェニルアミン溶液
-
ジフェミルアミン溶液 約100 ml ジフェミルアミン 1 g 濃硫酸 2 ml 氷酢酸 98 ml
- 蒸留水
器具
- ピンセット:1本/2人
- ホモジェナイザー:1本/2人
- 三角フラスコ:3個/実験台(蒸留水、0.12M NaCl、1M NaCl用)
- 遠沈管:1本/2人
- 天秤:1台/実験台
- 遠心機
- 試験管:2本/2人(DNA析出用、DNA定性用)
- ガラス棒:1本/2人
- 湯浴用器具:コンロ、鍋、試験管立て
- 10 ml 駒込ピペット:2本/2人(蒸留水、0.12M NaCl用)
- 5 ml 駒込ピペット:2本/2人(0.12M NaCl、1M NaCl用)
- 2 ml 駒込ピペット:1本/2人(上清用)
- 1 ml 駒込ピペット:1本/2人(蒸留水用)
- 5 ml 駒込ピペット:ジフェニルアミン試薬用
- 氷:発砲スチロール(蒸留水・食塩水 冷却用)と0.5 ℓ ビーカー(氷中作業用)
手順 (Flash Movie)
1.DNAの単離
- ホモジェナイザー(図5)に組織片5mm角と0.12 M(0.7%)食塩水10 ml を加え、氷中で冷却しながら、粉砕棒を回転させることで、丁寧にホモジェナイズする(すりつぶす)(注1,注2)。
- ホモジェナイズした溶液(ホモジェネート)を遠沈管に移す。3000 rpmで3分遠心後(注3)、遠沈管を傾けて、上清だけを捨てる。沈澱物に0.12 M 食塩水5 ml を加え、ガラス棒でよくかき混ぜ、再び3000 rpm で3分遠心後、遠沈管を傾けて、上清を捨てる。
- 沈澱物に1 M食塩水を5 ml 加え、ガラス棒で良く混ぜた後、ホモジェナイザーに移す。遠沈管の側壁に残っている沈殿物もしっかり回収するために、1 M(5.8%)食塩水3 mlを加え、洗うようにして、すべての沈殿物をホモジェナイザーに移し、ホモジェナイズする。ホモジェネートは、遠沈管に移し、3500 rpmで10分遠心する。遠心中に、で使用する蒸留水12mlを試験管にはかり、十分に氷冷しておく。
- の上清をピペットで2 ml 吸い取り、氷冷した蒸留水12mlが入った試験管に加える。ガラス棒で撹拌し、ガラス棒先端にDNAの繊維状結晶をできる限り巻きとる。
図5.ホモジェナイザー
2.DNAの確認
- DNAが巻き付いたガラス棒を1 ml の蒸留水を入れた試験管に入れる。その後、ジフェニルアミン試薬を2.5 ml 加え(注4)、撹拌したのち、5分間 沸騰水浴する。水道水で、冷却後、色の変化を観察する(図6)(注5)。
図6.デオキシリボースが存在した時のジフェニルアミン試薬の反応前後
左:試薬を加えた直後、右:沸騰水浴後、冷却したもの
3.Flash Movieによる手順
画面左下のアイコンについて
![]() 3秒間隔の自動でページを進めます。
3秒間隔の自動でページを進めます。
![]() そのページで停止します。
そのページで停止します。
![]() 手動で次のページを表示します。
手動で次のページを表示します。
![]() 一つ前のページに戻ります。
一つ前のページに戻ります。
再生にはAdobe Flash Playerが必要です。
ポイントやトラブルシューティング
- 注1:細胞に含まれるDNA分解酵素の働きを抑制するために、抽出・精製作業は、できるだけ氷中で作業する。
- 注2:ホモジェナイザーは丁寧に取り扱い、折らないようにくれぐれも注意する。
- 注3:遠心機は、使用法を誤ると非常に危険であるので、使用法をよく読んで使用する。
- 注4:ジフェニルアミン試薬は強酸性であるので、皮膚や衣服につけないように取扱いには注意する。また、この溶液は、ドラフト内、または換気を十分に行った場所で扱う。
- 注5:実験後、ジフェニルアミン試薬は所定の廃液ビンに集め、決して流しなどに流さない。DNAやタンパク質は、乾燥すると取れなくなるので、すべてのガラス器具はすぐに洗うようにする。
実験を成功させるための留意点
実験前
- 精巣は冷凍したものでも、実験に用いることができ、少し凍っているほうが小さな断片に切り分けやすい。
- 精巣断片が大きすぎると、本来溶解して、上清に含まれることで取り除くことができる物質が、溶液に溶けきらずに、沈殿のほうに混入してしまうことがあるので注意する。
実験中
- 上清と沈澱のどちらを捨て、どちらを残すのか、くれぐれも注意する。
- 遠心機を効率的に使うように注意する。
- 遠心機が壊れて、ケガをする恐れがあるので、遠心機の使い方には注意する(バランス、回転数調整、ふたの開閉など)。
- ホモジェナイザーは壊れやすく、高価な機器であることを事前に周知し、破損しないよう注意をうながす。
- ジフェニルアミン試薬の使用に関しては、ドラフトが整備されていることが望ましい。ジフェニルアミン試薬を用いず、メチレンブルー試薬でDNAを染色し確認する方法もある。この場合、DNAは、染色された繊維状の構造として、光学顕微鏡で観察できる。
- 使用する食塩水の量、遠心時間や回転数は、厳密に表示通りでなくてもよい。遠心機や遠沈管のサイズなどに応じて、調整する。
実験後
- 遠心管、試験管、ピペット、ホモジェナイザー、ガラス棒は、塩素系漂泊剤と洗剤を混ぜた溶液に2-3時間浸けた後、ピペット以外はブラシあるいはスポンジでこすり洗い。よく水洗する。
本実験の発展
- 動物の肝臓などほかの組織で 同様の作業をさせ、精巣にDNAが多量にふくまれることを実感させる。
資料
参考文献
- 文献1:Mirsky A. E. and Pollister A. W. (1942) Nucleoproteins of cell nuclei. Proceedings of the National Academy of Science (U.S.A.) vol.28: 344-352
- 文献2:岩井保(1991)「魚学概論」第2版 恒星社厚生閣
- 文献3:板沢 靖男・羽生功 編(1991)「魚類生理学」 恒星社厚生閣
- 文献4:由岐英剛(1984)「ジフェニルアミンによる比色法」、由岐英剛[編]生化学分析法 南江堂 pp.281-283
用語解説
- 真核生物
- バクテリア、シアノバクテリアなど核をもたない原核生物以外のすべての生物。核を有する細胞から構成されている。
- ジフェニルアミン溶液
- 試薬中の酸が、デオキシリボースに働くことで開環され、ω-hydroxylaevulinic aldehydeを生じる。これにジフェニルアミンが結合し、青色を呈する複合体が形成される。この反応は酸によって脱プリン(アデニン、グアニン)化させたデオキシリボースに対して生じ、ピリミジン(チミン、シトシン)と結合したデオキシリボースはほとんど呈色しない(文献4)。
印刷用PDFマニュアル
- DNAの抽出と同定
 (922KB)
(922KB)