マイタケのタンパク質分解酵素 †
実験のねらいと特徴 †
菌類(用語1)は生態系の中で分解者(用語2)という重要な位置を占めるが、生物学実験の材料としては比較的取り扱いが少ない。分解者として持つべき特性である分解酵素を抽出し、その役割を考えることを目的としている。本来は菌糸(用語3)を使って実験をすべきところであるが、子実体(用語4)(キノコ)にも分解酵素活性を強く持つものがあり、実験に使うことができる。身近な食材であるキノコが菌類であり、生態系では分解者であることを強く印象づけることがねらいである。実際の実験では、既知の濃度のタンパク質希釈列によって吸光度の検量線を作成し、酵素を添加したタンパク質濃度の経時変化からタンパク質分解酵素活性を測定する。これによってグラフの取り扱い、特に検量線という考え方の理解を目指す。
実験の流れ †
- 準備
- 前説明
- 生態系における菌類について
- タンパク質分解酵素について
- タンパク質の定量方法について
- 分光光度計の使い方と吸光度について
- 実験中
- マイタケ入り茶碗蒸しの準備
- タンパク質濃度と吸光度の検量線作成
- マイタケ抽出液によるタンパク質の分解と定量
- マイタケ入り茶碗蒸しの作成
- 実験後
- レポート作成と提出
- 片付け
はじめに †
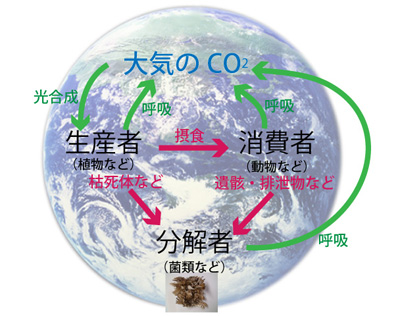
生物は、生態系内での働きに応じて、「生産者」「消費者」「分解者」に分類できる。「生産者」は、光エネルギーなどを原動力に二酸化炭素や硝酸塩を材料にして有機物を生産し、成長のための資材やエネルギーとする。「消費者」は自ら有機物を生産することができないため、他の生物を食べることにより有機物を取り込む。「分解者」は、環境中に存在する有機物(多くの場合、生産者や消費者の枯死体、脱落物、排泄物など)を取り込んで、無機物に分解する過程で生活に必要な物質とエネルギーを得ている(図1)。菌類は一般的に「分解者」であるため、セルロースをはじめとする様々な有機物を分解する酵素を菌糸から放出し、小さな分子に分解後、吸収する(外消化)。その酵素の一部が子実体であるキノコ(食用部分)に含まれる場合もある。今回実験に用いるマイタケはタンパク質分解酵素活性が強いことが知られており、数種類のタンパク質分解酵素について、至適温度や至適pHなどが調べられている。また、マイタケを生のまま卵液に入れ、茶碗蒸しを作ると、卵が固まらないことがあるというエピソード(文献1)から、酵素活性が身近なものとして感じられる材料と言える。
タンパク質は20種類のアミノ酸が、数十個〜数千個に渡って直鎖状にペプチド結合したものである(図2)。従属栄養の生物(動物や菌類)は取り入れたタンパク質を、タンパク質分解酵素(プロテアーゼ)によってアミノ酸に加水分解し、自己の遺伝情報に基づいてタンパク質に再構築している。
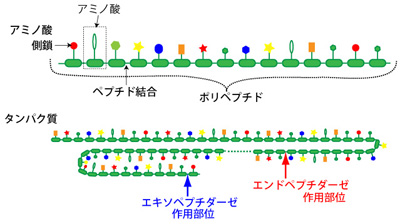 |
| 図2.タンパク質とプロテアーゼ |
| プロテアーゼは、作用部位により2種類のペプチダーゼとして分類されている。 すなわち、ポリペプチド鎖末端のペプチド結合を切断するエキソペプチダーゼと、 ポリペプチド鎖内部のペプチド結合を切断するエンドペプチダーゼ。 |
今回の実験ではマイタケの子実体を用いて、タンパク質分解活性を測定する。また、その酵素活性が、茶碗蒸しを作るときにどのように影響するか実験的に確かめる。
目的と課題 †
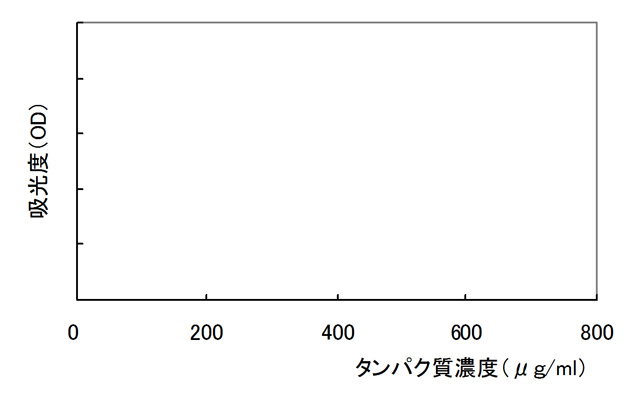
- (目的1)タンパク質濃度と吸光度(O.D)の検量線を作成する。
- (目的2)実験溶液の吸光度から各溶液中のタンパク質濃度を推定する。
- 課題2:実験溶液の吸光度から課題1で作成した検量線を用いて、タンパク質濃度を読み取り表4と5にまとめる。
- (目的3)マイタケ抽出液中のタンパク質分解酵素について考察する。
- 課題3:横軸に反応時間、縦軸にタンパク質濃度を取ってマイタケ抽出液によるタンパク質濃度の変化をグラフ2に表わす。
- 課題4:マイタケ入り茶碗蒸しの結果と課題3のグラフからマイタケ入り茶碗蒸しをうまく作成する方法とマイタケのタンパク質分解酵素について考察する。
実験 †
材料 †
- マイタケ(Grifola frondosa)
試薬 †
試薬の調整は、資料の試薬調整法 参照
- 緩衝液 (1ml /2人)
- タンパク質溶液 (615µl/2人)
- タンパク質比色検定試薬(3.2ml/2人)
- 卵液 (100ml/2人)
- マイタケ抽出液 (600µl/2人)
器具 †
- マイクロチューブ 8本/2人
- マイクロピペッター (P20, P1000)
- 16ウェルストリップ 1個/2人: 今回はハンドリング性能からNUNC 469922を使用したが、使用するマイクロプレートリーダーによって安価なマイクロタイタープレートを使用することもできる。
- ビーカー 2個/2人: 茶碗蒸し作成に使用
- 50℃恒温水槽 : 酵素反応に使用
- 蒸し器 : 茶碗蒸し作成に使用
- マイクロプレートリーダー(図3)(用語5): Bio-Rad Model 680 など
- グラフ用紙
- ロート、濾紙、注射器つき滅菌フィルター:マイタケ抽出液作成に使用
手順 †
- 茶碗蒸し実験の準備
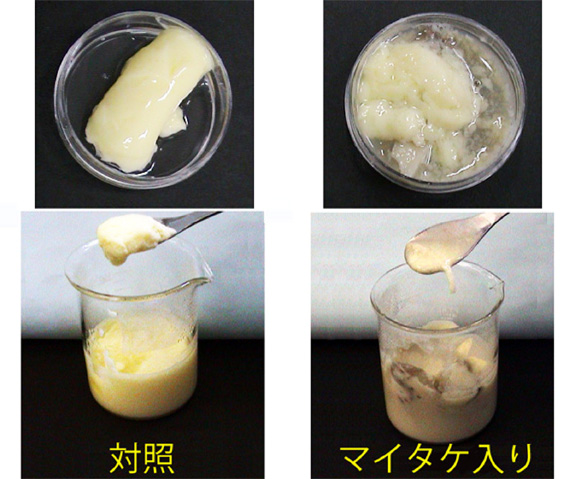
- 卵液50mlの入ったビーカー2個を用意し、一方にマイタケ断片5gを入れ、もう一方は卵液のみ(対照)として、他の実験が終了するまで放置する(図4)。
- マイタケを入れた時間を記録しておく。
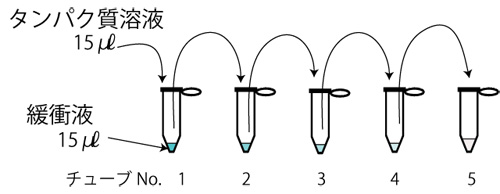
- 検量線のためのタンパク質溶液調整
- 吸光度測定
- 16ウェルストリップのタブに切り込みがある側を左にして、タブにI, IIと番号をつける。右タブには、班の名前を記入する(図6)。
- 16のすべてのウェルに染色液をP1000のマイクロピペッターで200µlずつ入れる。
- 各ウェルに、入れる溶液を、表1、表2と (図6)で確認する。
- マイクロチューブを3本用意してB-1からB-3の記号をつける。
チューブNo. B-1 B-2 B-3 基質 300 µl タンパク溶質液 緩衝液 タンパク溶質液 酵素 300 µl マイタケ抽出液 マイタケ抽出液 緩衝液 - 基質として、B-1とB-3のチューブには、タンパク質溶液300µl、B-2のチューブには緩衝液300µlを入れる。
- B-1に酵素液として、マイタケ抽出液300µlを加えたら、軽くピペッティングし、P20のマイクロピペッターで10µlをとり、0分後 B-1のウェルに入れる。酵素液を入れた時間を記録し、マイクロチューブは、直ちに50℃の恒温水槽に入れる。指示された時間経過後に溶液中のタンパク質量を測定するために、マイクロチューブから10µlをとり、対応するウェルに入れる(注2)。
- B-2に酵素液として、マイタケ抽出液300µlを加えたら、軽くピペッティングし、P20のマイクロピペッターで10µlをとり、0分後B-2のウェルに入れる(注3)。酵素液を入れた時間を記録し、マイクロチューブは、直ちに50℃の恒温水槽に入れる。30分後に、再度10µlをとり、対応するウェルに入れる。
- B-3は、酵素液のかわりに、緩衝液300µlを加えたら、ピペッティングし、P20のマイクロピペッターで10µlをとり、0分後 B-3のウェルに入れる。緩衝液を入れた時間を記録し、マイクロチューブは、直ちに50℃の恒温水槽に入れる。30分後に、再度10µlをとり、対応するウェルに入れる。
- A-1からA-5および緩衝液も10µlをとり、対応するウェルに入れる。
- 最後の溶液をウェルに入れてから5分経過後、16ウェルストリップをフレームにセットして595nmの吸光度を計測する(図7)(注4)。
タンパク質濃度
(μg/ml)720 360 180 90 45 吸光度 反応時間 0分後 5分後 15分後 20分後 30分後 吸光度 タンパク質濃度(μg/ml) タンパク質濃度の変化量 0 B-2 B-3 反応時間 0分後 30分後 0分後 30分後 吸光度 タンパク質濃度(μg/ml) タンパク質濃度の変化量 0 0
- 茶碗蒸しの作成
1.で準備した卵液を湯気の立った蒸し器に入れ、強火1分加熱後、弱火にして、15分くらい加熱し、茶碗蒸しを作る。さじなどですくって固まり具合を記録する(図8)。 実験結果には、マイタケを加えてから加熱を開始するまでの時間を明記する。
ポイントやトラブルシューティング †
- 注1:検量線を描くための希釈は正確に行わなければならないので、ピペット操作に不安のある場合は、容量を増やして行うか、教員が作成して配布するとよい。
- 注2:基質と酵素液が均一になるようにピペッティングするときは、泡を立てないようにやさしく行い、溶液を入れる前に、ウェルの位置を十分に確認する。
- 注3:0分後B-1の溶液をウェルに入れたら、すぐにB-2の操作を始め、続いて、B-3の操作をすると実験時間を短縮することができる。
- 注4:計測器からでてきたデータがどの溶液のものか間違えないように注意する。
実験を成功させるための留意点 †
実験前
- マイタケ抽出液は、内在の余分なタンパク質を分解させるために、一晩37℃で静置する。
実験中
- マイクロピペッターのチップは、溶液ごとに交換するように注意する。
実験後
- タンパク質比色検定試薬は所定の廃液ビンに集め、流しなどに流さないように注意する。
本実験の発展 †
- 他の種類のキノコで同様の実験を行うことで、キノコの種類によるプロテアーゼ活性を比較することができる。
資料 †
試薬調整法 (Flash Movie) †
| 10倍濃度PBS | 100ml |
| KCl | 0.2g |
| KH2PO4 | 0.2g |
| NaCl | 8g |
| Na2HPO4・12H2O | 2.9g |
| 蒸留水で100mlにメスアップ | |
- タンパク質溶液 (1440 µg/ml BSA ウシ血清アルブミン用語6)
BSAのグラムに合わせて、溶解させる蒸留水の量を濃度が1440 µg/mlになるように調整する。
- タンパク質比色検定試薬 (3.2ml/2人): Bio-Rad® Protein Assay Dye Reagent Concentrate
タンパク質の定量にはBradford法を用いる。この方法はタンパク質がCoomassie Brilliant Blue G-250と結合することにより、吸光波長が465nmから595nmに変化する性質を利用している。分子量が5 kDa以上のタンパク質を測定できる。3 kDa以下のペプチド、アミノ酸は反応しない。タンパク質溶液として用いるBSAは、65 kDaなので、分解されなければ、595nmでの吸光度として現れる。
- 卵液 (100ml/2人):
全卵をほぐし、3倍量の水道水(または、だし汁)で希釈し、茶漉しで漉して茶碗蒸しの作成に用いる。だし汁を用いない場合は、卵液が固まりやすいように食塩を1%濃度(文献2)になるように加える。
- マイタケ抽出液(600µl/2人):
子実体100gを細かく刻み200 mlの緩衝液を加え、室温で約1時間抽出する。ろ紙をひいたロートを使って子実体断片と抽出液を分離する。抽出液を細胞培養などで使用するフィルターつき注射器で滅菌ろ過する。一晩37℃に静置して、内在の余分なタンパク質を分解させたものをマイタケ抽出液(粗酵素液)とする(図9参照)。なお、子実体は、刻んで―20℃で保存したものでも使用可能であった。
図9.Flash Movieによるマイタケ抽出液の作り方
画面左下のアイコンについて
 3秒間隔の自動でページを進めます。
3秒間隔の自動でページを進めます。
 そのページで停止します。
そのページで停止します。
 手動で次のページを表示します。
手動で次のページを表示します。
 一つ前のページに戻ります。
一つ前のページに戻ります。
再生にはAdobe Flash Playerが必要です。
参考文献 †
- 文献1:大野信子、仁平佳奈、小平了二(1995)「マイタケ(Grifola frondosa (Fr.) S.F.Gray)子実体から溶出する加水分解酵素」和洋女子大学紀要、第35集(家政系編)、11-19
- 文献2:農林水産省消費安全技術センター(1998) マイタケ入り茶碗蒸し 広報誌「大きな目小さな目」5月第39号 (http://www.famic.go.jp/public_relations_magazine/kouhoushi/tokusyuukiji/products_knowledge/st39.html)
用語解説 †
- 菌類
- 細胞壁を持ち、動物のような移動を行わないものが多いため、以前は下等な植物として扱われることもあった。現在の生物学分野では真菌類(カビ・キノコなど)に真性粘菌・細胞性粘菌などを会わせた総称として用いられることが多い。極めて広義に解釈した場合、原核生物である細菌類を含める場合もあるが、生物学分野では一般的でない。吸収型の従属栄養生物であり、生態系の中では分解者として重要な位置を占める。
- 分解者
- 動植物の遺体や排泄物などを分解して栄養を得ている生物で、遺体などはこの働きによって生産者(植物)が利用できる無機化合物に分解される。細菌類・菌類・土壌生物(ミミズなど)がふくまれる。
- 菌糸
- キノコ(カビも同様である)の本体は栄養物の存在する場所に張り巡らされる菌糸であると言え、ここから栄養物を吸収して成長する。栄養状態や気候が変動すると子実体であるキノコを形成して胞子を散布する。
- 子実体
- キノコは胞子を効率よく飛散させるために、子実体を形成する。食用となるのは主としてこの部分である。
- マイクロプレートリーダー
- 光源から発せられる光がマイクロウェルを通過する際にどれだけ減じたかを計測する分光光度計の一種。多くの場合12x8のマイクロプレートに対応し、96サンプルを連続して計測できるので、大量のサンプルを処理するのに向いている。
- ウシ血清アルブミン(BSA)
- 血清アルブミンは血液中に最も多く含まれるタンパク質である。可溶性が高いこと、手頃な分子量であること、安価であることから今回の実験に採用されている。
印刷用PDFマニュアル †
添付ファイル: