酵素反応の特質を知る―酵素チロシナーゼによるメラニンの形成
酵素基質特異性や阻害剤について調べる。
実験のねらいと特徴
ジャガイモからメラニン形成に重要な働きをする酵素であるチロシナーゼを分離し、分離した酵素をいくつかの条件で反応させる。この実験を通して、生体化学反応の触媒である酵素の特性を学ぶ。酵素の分離にあたり、ゲル濾過クロマトグラフィーを体験し、その原理を理解する。
実験の流れ
- 準備
- 材料、試薬、器具の準備
- ジャガイモの切り分け (なるべく実習開始直前に行う)
- 前説明
- 酵素の特性について
- チロシナーゼついて
- ゲル濾過クロマトグラフィーの原理
- チロシナーゼ分画の同定法
- 実験中
- ゲル濾過クロマトグラフィーによるチロシナーゼの分離
- 比色検定によるチロシナーゼ分画の同定とその定性実験
- 実験後
- レポートの作成・提出
- ゲル濾過カラムの洗浄と片付け
はじめに
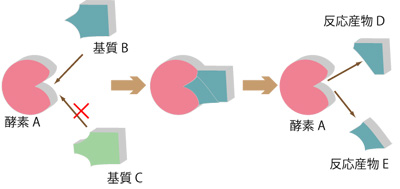
生物体は、様々な化学反応が複雑に組み合わさって生命を維持している。生体というマイルドな環境にも関わらず、それらの反応の効率が高いのは、「酵素」とよばれる生体触媒が関与しているからである。酵素は、特定の物質の特定の化学反応のみに働くという「基質特異性」を有している(図1)。
図1.酵素反応モデル
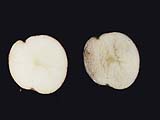
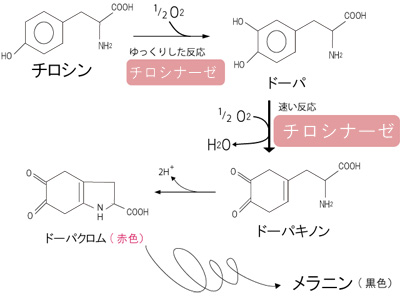
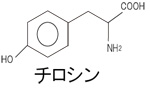
そのため、反応の数だけ、酵素が存在するといわれている。様々な物質が混在している生体内で、化学反応が秩序正しく進行するには、酵素の「基質特異性」が重要な役割を担っている。 酵素の本体はタンパク質であり、その基本構造は、アミノ酸が直線的に並んだものであるが、酵素が基質に働くためには、鍵と鍵穴のように、その立体的な構造が基質の構造とうまく合わなければならない。タンパク質の立体構造は、pHや温度により変化するため、それぞれの酵素反応には、最適なpHや温度(至適pH、至適温度)が存在する。 チロシナーゼは、銅イオンと結合して活性をもつ酸化酵素の一種で、動物の皮膚や昆虫の体液、植物の細胞内に存在し、チロシンやドーパを基質として、ドーパキノンを生成する。ドーパキノンは、自動的に酸化され、赤褐色のドーパクロムとなり、さらに複雑な反応経路を経てメラニンになる(図2)。ジャガイモやリンゴを切ってしばらく置いておくと空気に触れた切り口が黒くなるのは、植物に含まれるこの酵素の働きにより、メラニンが形成されるためである。
図2. チロシナーゼによるチロシンからメラニンへの反応経路
目的と課題
- (目的1)ジャガイモの抽出液からゲル濾過カラムを用いてチロシナーゼを調製する。
-
- 課題1:分画の比色分析(Bセット、Cセット)の結果を表にまとめる(表1)。
- 課題2:表1より、チロシナーゼを含む分画(チロシナーゼ分画)を同定する。また、なぜ、その分画にあると推定したか理由をまとめる。
- (目的2)表2の反応液において、酵素(チロシナーゼ)の性質を調べる。
-
- 課題3:酵素の定性試験(Dセット)の結果を表にまとめる(表3)。
- 課題4:Dセットの実験結果からどのようなことが言えるか。
- 課題5:粗抽出液および酵素液(チロシナーゼ分画)は、それぞれ実験終了時にどのようになっているか、違いを観察し、その理由をまとめる。
実験
材料
- ジャガイモ:1片/2人(班)
- 小型のじゃがいもでは1/2個、大型では1/4個程度。
試薬
- 緩衝液:9.57mMリン酸緩衝生理食塩水(PBS), pH7.35~7.65
- PBSタブレット(タカラバイオ株式会社)10錠を蒸留水に溶かし、1ℓにメスアップする。
- 300 mg/l チロシン溶液:6ml/2人
- チロシンを少量の0.1N NaOHに溶かし、PBSを加える。 pHが高くなるので、1N HClを慎重に加えて、pHを7.5~8.0くらいに調整する。使用日に溶液1ℓに対して、ドーパを極少量(耳かき半分適度)加え攪拌する。
| チロシン溶液 | 1000 ml |
| チロシン | 300 mg |
| ドーパ | 少量 |
| 0.1N NaOH | 少量 |
| 1N HCl | 少量 |
| PBSで1000 mlにメスアップ | |
試薬
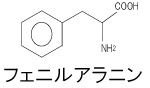
- 300 mg/l フェニルアラニン溶液:500μl/2人
| フェニルアラニン溶液 | 500 ml |
| フェニルアラニン | 150 mg |
| PBSで500 mlにメスアップ | |
フェニルアラニン
-
1%ビタミンC溶液:20 μl/2人
-
アスコルビン酸ナトリウムを使用。
-
タンパク質比色検定試薬:5 ml /2人
-
Bio-Rad® Protein Assay Dye Reagent Concentrate
器具
手順
図3. 酵素液調整手順1: ジャガイモの処理
1.酵素液の調整
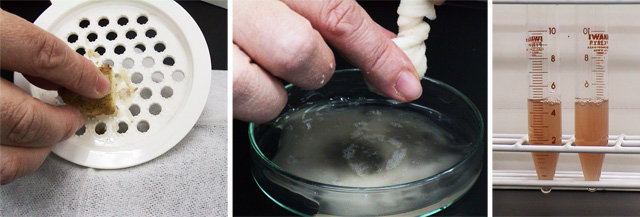
- シャーレにガーゼを2枚敷き、その上に、ジャガイモをおろし板ですりおろす(図3左)(注1)
- ガーゼの上から緩衝液10 mlを加えてシャーレに濾過する。ジャガイモの成分ができるだけ溶出するように、ガーゼを濾液中で何度か揺する。最後に、ガーゼを持ち上げ、最後の一滴まで絞り出す(図3中)(注2)。
- 1分間放置してデンプンを沈殿させる。シャーレを静かに傾けながら、2mlの駒込ピペットを用いて、上清(粗抽出液)を試験管に移す(図3右)(注3)。
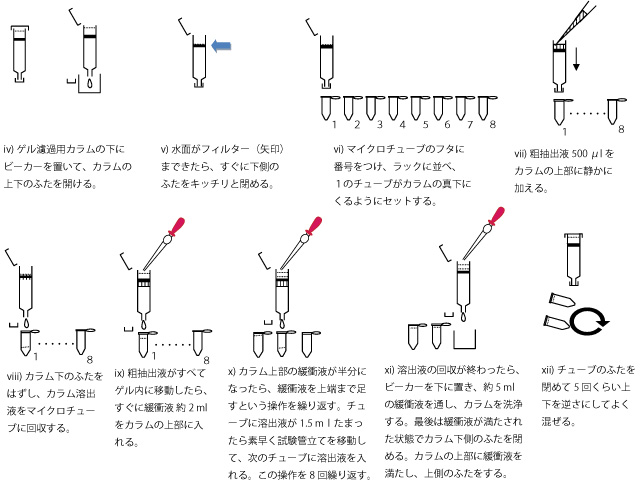
- スタンドに固定したゲル濾過用カラムの下にビーカーを置いて、カラムの上下のふたを開ける(図4)(注4)。
- カラムの上部に入っていた緩衝液の水面がフィルターのところにきたら、すぐに下側のふたをキッチリと閉める(図4右)。
- 8本のマイクロチューブ(Aセット)のフタに番号をつけ、ふたを開けたままラックに並べ、1のチューブがカラムの真下に来るようにセットする(図5)。
- P1000を用いて試験管内の粗抽出液を 500 μlとり、カラムの上部に静かに加える(図5)(注5)。
- カラムの下側のふたを開けて、溶出液をマイクロチューブに回収を開始する(図5)。
- 粗抽出液が全てゲル内に移動したらすぐに、2mlの駒込ピペットを用いて、緩衝液約2mlをカラムの上部に入れる(図5)。
- カラム上部の緩衝液が半分くらいまで減ってきたら緩衝液を上端まで足すという操作を繰り返す。1のチューブに溶出液が1.5 ml(チューブ上部の線のところ)までたまったら素早く試験管立てを移動して、2のチューブに溶出液を入れる。この操作を8回繰り返す(図5)。
- 溶出液の回収が終わったら、ビーカーを下に置き、約5 mlの緩衝液を通し、カラムを洗浄する。最後は緩衝液が満たされた状態でカラム下側のふたを閉める。カラムの上部に緩衝液を満たし、上側のふたをする(図3)。
- チューブのふたを閉めて5回くらい上下を逆さにしてよく混ぜる(図5)(注6)。
図4. 酵素液調整手順2: カラムの準備
図5. 酵素液調整手順3:カラムの取扱い
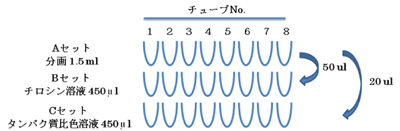
2.分画の比色分析 (図6)
- 1~8の番号をつけたチューブをBとCの2セット用意する。
- Bセットのチューブすべてにチロシン溶液(基質溶液)をP1000で450 μl 加える。
- Cセットのチューブすべてにタンパク質比色検定試薬をP1000で450 μl 加える(注7)。
- Aセットのそれぞれの分画をBセットには50μl、Cセットには20 μl、 P200で手早く加える(注8)。
- 30分後に溶液の色の変化を調べる(表1)(注9)。
図6. 分画処理手順
| 表1.各分画における溶液の色 |
| チューブNo. | ||||||||
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | |
| (B)チロシン溶液・処理前 | ||||||||
| (B)チロシン溶液・処理後 | ||||||||
| (C)比色検定試薬・処理前 | ||||||||
| (C)比色検定試薬・処理後 | ||||||||
3.酵素の定性試験
- Dセットとして1~4の番号を記したチューブを用意し、以下の反応液を調製する(表2)。すべてのチューブに基質と阻害剤を入れたのち、酵素液を最後に手早く加え、酵素液添加30分後の様子を観察する(注9)。
注意:酵素溶液は2の実験結果を参考にし、酵素がもっともたくさん含まれていると考えられる分画を使用する。 - チロシナーゼ分画の処理前後(30分)の色の変化を調べる(注9)(表3)。
| 表2.定性試験の反応液の組成 |
| チューブNo. | 基質 450 μl | 阻害剤20μl | 酵素液50 μl |
| D-1 | チロシン溶液 | 緩衝液 | チロシナーゼ分画 |
| D-2 | チロシン溶液 | 緩衝液 | 緩衝液 |
| D-3 | フェニルアラニン溶液 | 緩衝液 | チロシナーゼ分画 |
| D-4 | チロシン溶液 | ビタミンC溶液 | チロシナーゼ分画 |
| 表3.定性試験の結果 |
| チューブNo. | ||||
| D-1 | D-2 | D-3 | D-4 | |
| 酵素溶液処理前 | ||||
| 酵素溶液処理後 | ||||
ポイントやトラブルシューティング
- 注1:皮まですりおろす。
- 注2:じゃがいものカスが濾液に入らないように注意する。
- 注3:上清には、デンプン粒が入らないように気をつける。上清を2500rpmで5分遠心分離することにより、デンプン粒の混入を防ぐ方法もある。
- 注4:カラムは、常に溶液で満たされている状態を保ち、涸らさないように注意する。
- 注5:沈殿しているでんぷんを吸わないように気をつける。
- 注6:混ぜるとき、内部の溶液を泡立てないように注意する。
- 注7:タンパク質比色検定試薬は、タンパク質と結合すると青く発色するので、タンパク質の濃度が高いほど濃い青色となる。
- 注8:チロシナーゼ分画は手早く最後にいれる。
- 注9:室温によって、反応時間を10~30分の間で適宜、調整する。
実験を成功させるための留意点
実験前
- チロシン溶液の調整法に注意する(詳しくは『試薬』へ)。
実験中
- ゲル濾過のためのカラム操作において、デンプンを入れないようによく注意する。
- カラム操作の前に必ずマイクロチューブに画分を示す番号を記入する。
- 同じ反応時間で実験結果を比較させるために、酵素特性の実験では、先に種々の溶液を準備させておき、最後に酵素液を手早く入れさせることを注意する。
実験後
- タンパク質比色検定試薬は、所定の廃液ビンに集め、流しなどに流さないように注意する。
- (a)酵素はどの分画にあったか、どうしてそう言えるのか、(b) 酵素特性の実験から何が言えるのか、(c)粗抽出液およびチロシナーゼ分画は、実験終了時にどのようになっているか、違いと原因は何かなどの項目ごとに考えさせ、それらを含めた形で考察させることに留意する。
本実験の発展
- 分子量に大差のある色素を用いて、ゲル濾過クロマトグラフィーの原理を理解する実習と組み合わせることにより、実験の操作もスムーズになり、理解を深めることができる(『ゲル濾過クロマトグラフィーの使い方』参照)。
- 酵素反応の至適pHや温度を求める実験などに展開させることもできる。
- 熱による変性、基質特異性などの酵素の性質を確かめるための実験を学生自身が考案し、実行するようなプログラムにし、仮説から結果を導く実験のやりかたを習得するプログラムにすることができる。
資料
用語解説
- 酵素
- 生体内での化学反応を触媒する物質。
- 触媒
- 化学反応の反応速度を速める物質で、触媒自身は、反応の前後で変化しない。
- ゲル濾過クロマトグラフィー
- カラムに詰めたゲルにサンプルを流して、試料の分子サイズにより篩わけをする物質の分離方法。ビーズ状のゲルには小さな孔が多数存在し、分子サイズの小さいものは、その孔を出たり入ったりしながら、ゆっくり移動する。一方、大きな分子は、孔に入れずにゲルの間をすり抜けるため、早く移動する。(『ゲル濾過クロマトグラフィーの使い方』参照)
- 基質特異性
- 特定の基質の立体構造を認識して、その基質に対してのみ反応を促進する酵素の特性。
印刷用PDFマニュアル
- 酵素反応の特質を知る
 (719KB)
(719KB)