ゾウリムシの繊毛運動 ― 金属イオンの影響 †
実験のねらいと特徴 †
食品の栄養成分表示義務から、金属元素の名称を日常生活でも目にする機会が増えてきた。この実験では、身近な金属イオンに対する興味を促すことをねらいとし、ゾウリムシに、種々の金属イオンを与え、その遊泳行動を観察する。特に、繊毛運動を阻害する金属イオンと活発にする金属イオンの両方を用いることで、金属イオンの生体に対する毒性と有用性の両方を観察できることを特徴とする。
実験の流れ †
- 準備
- 前説明
- ゾウリムシについて
- ゾウリムシの繊毛運動について
- 実体顕微鏡の使い方について
- 実験中
- ゾウリムシ遊泳行動の観察
- 繊毛運動における金属イオンの影響を観察
- 実験後
- レポートの作成・提出
- ゾウリムシの回収・片付け
はじめに †
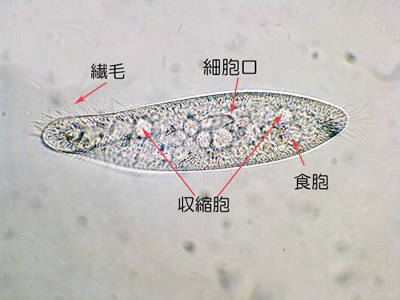
ゾウリムシは単細胞の原生生物である(図1)。単細胞生物は、独立した生物として生存するために、1つの細胞での中に、さまざまな機能をもつ細胞器官を備えている。ゾウリムシの場合、移動のための繊毛、食べ物を取り入れる細胞口、食べ物を消化するための食胞、浸透圧調節のための収縮胞などがそれにあたる。
ゾウリムシは、環境の温度、pH、化学組成、照度などの変化に対して、繊毛運動を変化させることが知られている。繊毛は、統合された規則的な動き(有効打と回復打)を繰り返しているが、その有効打の方向により、ゾウリムシの遊泳方向が決まる。そのため、繊毛運動の変化は、回避や集合反応をもたらし、その結果として、個体が適した環境を選択する事が可能になる。 繊毛や鞭毛の構造は、すべての真核生物において共通しており、中心に2本の微小管とその周囲に9本の二連微小管から形成された(「9+2構造」という)軸糸を有する(図2)。この二連微小管に結合するダイニンがATPを分解し、隣り合う二連微小管上を滑る。この滑りにより、繊毛打が生ずる。これらのことから、繊毛の動きは、ダイニンのATP加水分解酵素活性と密接に結びついていると考えられる。また、この酵素は、Mg2+(マグネシウムイオン)やCa2+(カルシウムイオン)で活性化されることが知られている。そこで、ゾウリムシの繊毛運動を抑制するNi2+(ニッケルイオン)の影響と、Ni2+により停止した繊毛運動が、他の金属イオンを用いることで回復するかどうか遊泳行動を観察して調べ、各種金属イオンの繊毛運動に与える効果を考察する。
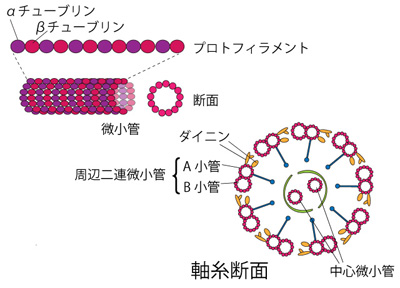 |
| 図2.繊毛の断面図 (9+2構造) 二連微小管のA小管に結合するダイニンがATPを分解し、隣り合う二連微小管の B小管上を滑る。この滑りのタイミングが、隣り合う微小管の間でズレることにより、 軸糸が屈曲し、繊毛打が生ずる。 |
目的と課題 †
- (目的1)培養液中のゾウリムシの遊泳行動を観察する。
- 課題1:ゾウリムシの形と泳ぐ方向を図示する。遊泳軌跡を描くことで、通常の遊泳速度を実感する。
- (目的2)Ni2+が遊泳行動に与える影響を4種類の濃度で観察する。
- (目的3)NiCl2で遊泳を止められたゾウリムシに対する、他の金属イオンの影響を調べる。
実験 †
材料 †
- ゾウリムシ(Paramecium caudatum):5ml/試験管
約10匹/75μlの密度にしておく。密度が低い場合は、手回し遠心機などを利用して、密度を調節する。
試薬 †
- 塩化ニッケル(NiCl2・6H2O, MW=237.69)溶液:
100 mM NiCl2溶液 100 ml NiCl2・6H2O 2.38 g 蒸留水で100mlにメスアップ - 目的2の実験で使用
- 0.5 mM :100 mM NiCl2溶液 1 mlを蒸留水で200mlにメスアップ。
- 0.3 mM :100 mM NiCl2溶液0.6 ml を蒸留水で200mlにメスアップ。
- 0.1 mM :100 mM NiCl2溶液0.2 mlを蒸留水で200mlにメスアップ。
- 0.02 mM :100 mM NiCl2溶液0.04 mlを蒸留水で200mlにメスアップ
- 目的3の実験で使用
- 0.2 mM :100 mM NiCl2溶液0.4 mlを蒸留水で200mlにメスアップ。
- 0.2 mM :100 mM NiCl2溶液0.4 mlを蒸留水で200mlにメスアップ。
- 目的2の実験で使用
- 100mM塩化カルシウム(CaCl2・2H2O, MW=147.01) 溶液:
100 mM CaCl2溶液 100 ml CaCl2・ 2H2O 1.47 g 蒸留水で100mlにメスアップ - 100mM塩化マグネシウム(MgCl2・ 6H2O, MW=203.30) 溶液:
100 mM MgCl2溶液 100 ml MgCl2・ 6H2O 2.03 g 蒸留水で100mlにメスアップ - 100mM塩化バリウム(BaCl2・2H2O, MW=244.26) 溶液:
100 mM BaCl2溶液 100 ml BaCl2・2H2O 2.44g 蒸留水で100mlにメスアップ
器具 †
- 試験管:9本/班
- 試験管立て:1台/班
- マイクロピペッター:1本/人
- 血液反応板:1枚/人
- ストップウォッチ:1台/人
- キムワイプ®:適当
手順 †
- ゾウリムシの遊泳行動の観察
- Ni2+ が遊泳行動に与える影響
- ゾウリムシ懸濁液75μlを血液反応板にとり、10匹程度ゾウリムシがいることを確認した後、NiCl2を75μl加え、攪拌する(注4)。
- ゾウリムシの半数が遊泳を停止した時間を記録できるように、遊泳速度や泳ぎ方の変化に注意して、NiCl2を加えてから3分間は、連続で観察をおこない、その後は、3分おきに12分まで観察する。4種類の濃度のNiCl2で同じ操作を行い観察する(注5)。
- 結果を表1、表2、グラフ1にまとめる。
NiCl2濃度
(mM)n* 0〜3分 6分後 9分後 12分後
0.01
0.05
0.15
0.25*実験に使用した個体数NiCl2濃度
(mM)0.01 0.05 0.15 0.25 時間
(分)
- 他の金属イオンがNi2+ により遊泳停止したゾウリムシに与える影響
| 金属イオン の種類 | n* | 0〜3分 | 6分後 | 10分後 | 遊泳 して いる数 | 遊泳し ている 割合(%) |
CaCl2 | ||||||
MgCl2 | ||||||
BaCl2 | ||||||
蒸留水 (対照) |
ポイントやトラブルシューティング †
- 注1:ゾウリムシは負の走地性のため、水面近くに集まっているので、均一にしてからでないと、適当な数が取れないので注意する。
- 注2:血液反応板の容量に応じて、ゾウリムシや試薬の量を調整する。
- 注3:ホールスライドグラスでは、浅すぎるため、血液反応板を使用。
- 注4:加えた溶液が均一になるように、ピペッティングする。ゾウリムシ懸濁液とNiCl2溶液を等量加えているので、Ni2+濃度は、加えたNiCl2溶液の濃度の半分になる。
- 注5:溶液を変えるときは、キムワイプ®等で液体をふき取り、1回毎に洗浄する必要はない。
- 注6:二人で組になり、4種類の溶液を2つずつ担当し、データを共有することで時間を短縮することもできる。
- 注7:データは班やクラスで共有し、グラフを作成する。
実験を成功させるための留意点 †
実験前
- ゾウリムシの準備には少なくとも2週間の時間の余裕をもつ。
実験中
- 溶液が混ざらないようにマイクロピペッターのチップは、溶液ごとに交換させる。
- Ni22+による遊泳停止後のゾウリムシに及ぼす金属イオンの影響を調べる実験では、Ni2+処理時間が長すぎると金属イオンによる回復が見られなくなるので、処理時間には、十分に注意をさせる。
本実験の発展 †
CaCl2やMgCl2との比較として挙げた BaCl2溶液の代替としてKClやNaClなどの溶液も使用できる。カリウムイオンやナトリウムイオンは、「神経」の話題で必ず登場する金属イオンのため、授業にも導入しやすいと考えられる。
資料 †
参考映像 †
- 画像をクリックするとPC内の動画再生ソフトにより直接動画が再生されます。
- 直接再生されない場合は、Windowsでは画像上で右クリック後、「対象ファイルを保存」し、保存したファイルを動画ソフトで再生してください。
- ファイル形式はmpg1です。
参考文献 †
- 重中義信 監修 (1988) 原生動物の観察と実験法、共立出版
- 内藤豊 (1990) 単細胞動物の行動―その制御のしくみ―、東京大学出版会
- 上村慎治 (2002) 細胞のかたちと運動、宝谷紘一・神谷律 編、共立出版
- 中村桂子・松原謙一監訳(2004) 細胞の分子生物学 第4版 (Bruce Alberts, Alexander Johnson, Julian Lewis, Martin Raff, Keith Roberts, Peter Walter, “Molecular Biology of the Cell” )、ニュートンプレス
- 鈴木範男、神谷律(2007)細胞の生物学 培風館
用語解説 †
- ゾウリムシ
- 単細胞の原生生物で、繊毛虫の一種。その特性から、細胞生物学、遺伝学、電気生理学などの分野で幅広く研究材料として使われている。
- 原生生物
- 動物、植物、菌類以外の真核生物。褐藻類、紅藻類やミズカビ類、粘菌、細胞性粘菌、アメーバ、ゾウリムシがこのグループに属する。
- 真核生物
- 細胞核をもつ生物で、動物、植物、菌類、原生生物などほとんどの生物が真核生物である。一方、細胞核をもたない生物を原核生物と呼ぶ。
- 二連微小管
- 1本の完全な微小管と別の微小管が融合して、共通の管壁をもつようになった微小管。鞭毛や繊毛の9+2構造の周辺微小管は二連微小管よりなる。
- ダイニン
- 微小管と結合するたんぱく質であり、ATP加水分解酵素で生じたエネルギーを滑り運動に変換するモーターたんぱく質の1つ。細胞質ダイニン、繊毛ダイニンなどがある。
印刷用PDFマニュアル †
添付ファイル: